Há 150 anos, quando pouco mais de 60 elementos químicos eram conhecidos, o químico russo Dmitri Mendeleev, professor da Universidade de São Petersburgo, apresentou ao mundo a primeira versão de um dos maiores ícones da ciência moderna: a tabela periódica.
Àquela altura, a alquimia, uma espécie de ancestral mística da química, já havia ficado pra trás, e o conhecimento científico se acumulava rapidamente. Poucos, porém, se dedicavam a sistematizar o que já havia sido descoberto.
No fim do século 18, Lavoisier e outros cientistas já separavam os elementos em grupos como metais e gases, mas ainda se sabia pouco sobre suas propriedades químicas —como os elementos interagem uns com os outros e também a presença de características semelhantes em diferentes elementos.
O que Mendeleev fez foi criar um sistema que, além de catalogar os elementos, permitiu a previsão de propriedades como densidade, reatividade e estabilidade por causa da organização deles, como explica Henrique Toma, professor titular de química da USP, entusiasta de tudo que envolve a tabela periódica e colecionador de elementos químicos, exibidos em um grande mostruário em forma de tabela periódica no Instituto de Química da universidade.
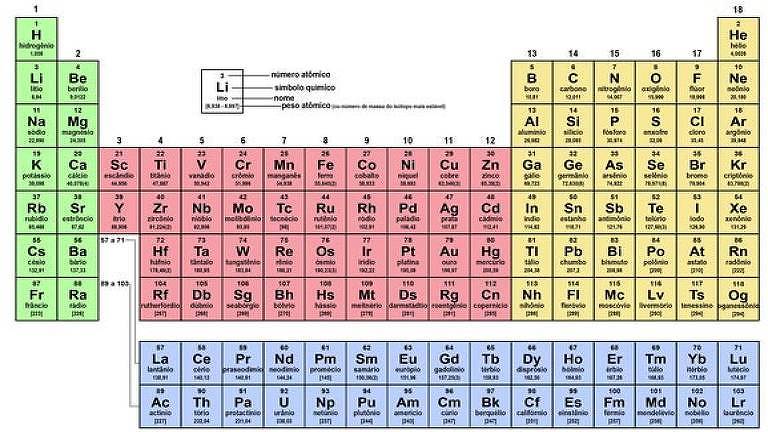
Pela sequência proposta por Mendeleev, os elementos que estão um ao lado do outro na linha horizontal têm propriedades químicas que se repetem de tempos em tempos, a tal periodicidade. E os elementos com características semelhantes ficam na mesma coluna, ou grupo.
Um dos grupos mais famosos é o dos metais alcalinos, o primeiro da tabela e lembrado até por quem saiu da escola faz tempo graças à frase Hoje Li Na Kama Robinson Crusoé em Francês —um jeito de decorar a ordem de lítio, sódio, potássio, rubídio, césio e frâncio. O hidrogênio não é um metal, mas fica logo ali acima e entrou na brincadeira.
Todos os metais alcalinos compartilham características como a formação de sais com os elementos da família dos halogênios e a alta reatividade de suas formas metálicas puras na água, que podem causar intensas explosões graças à formação de gás hidrogênio (H2).
Em 1869, fazia poucas décadas que o sódio (Na), o potássio (K) e o magnésio (Mg) haviam sido isolados em suas formas metálicas pelo britânico Humphry Davy. Para isolar o sódio, ele esquentou e derreteu soda cáustica (NaOH) com o auxílio de uma corrente elétrica, técnica conhecida como eletrólise.
Essa é só uma das maneiras de separar elementos químicos que muitas vezes só aparecem na natureza conjugados a outros átomos, como óxidos, sais e minerais —basicamente, terra e pedras.
Outro jeito de identificar elementos é promover reações com ácidos, capazes de corroer materiais e liberar gases, queimá-los e analisar a cor da chama, além de esquentar, fundir e separar elementos —técnicas aprendidas e refinadas desde a Idade do Bronze, milênios antes de 1869.
O primeiro elemento descoberto por um indivíduo provavelmente foi o fósforo (P), em 1669. O alquimista alemão Hennig Brand processou centenas de litros de urina em uma sucessão de etapas até obter poucos gramas do elemento. Duzentos anos depois, em 1869, já se sabia que carbono, silício e estanho apresentavam algumas propriedades químicas semelhantes, especialmente a forma como se ligam a outros elementos, como o oxigênio e o hidrogênio.
Publicações em revistas especializadas e alguns congressos acadêmicos tentavam dar ordem ao conhecimento que se multiplicava, mas só em 1892 houve um encontro, realizado em Genebra, na Suíça, para lidar com a questão dos nomes dos elementos. A Iupac (União Internacional de Química Pura e Aplicada), responsável por reconhecer as descobertas e aprovar os nomes, só nasceria em 1919.
Visionário, Mendeleev pensava que elementos químicos, unidades formadora de compostos como sais, óxidos e ácidos, poderiam ser categorizados apenas pela massa atômica. Mesmo com conhecimento escasso, previu que alguns deles deveriam ser descobertos com determinados valores de massa —um deles era acertadamente o germânio.
A ideia era boa, mas não estava correta. O que define a maior parte das propriedades químicas de um elemento é a quantidade de prótons no núcleo de um átomo, conhecimento que só veio décadas depois. Mesmo assim, a tabela de Mendeleev, que foi sendo aperfeiçoada ao longo do tempo, já era muito próxima da que temos hoje, com os grupos químicos (colunas) apresentados praticamente da forma como conhecemos.
A partir do urânio (92), os elementos não foram descobertos por reações químicas ou decompondo substâncias por eletrólise, mas, sim, criados em laboratório a partir da colisão entre átomos e entre átomos e partículas subatômicas —as chamadas reações nucleares.
Quem tem especial interesse nessa área são os físicos nucleares, mas são os químicos que estão sempre a postos para batizar e reconhecer elementos.
A desavença entre as sociedades de química (Iupac) e física (Iupap) teve auge no fim de 2015 e no início de 2016, quando a primeira anunciou sozinha o reconhecimento dos elementos 113, 115, 117 e 118, antes mesmo do aval do comitê formado por cientistas também da Iupap.
É também a partir do urânio que os elementos criados começam a ser batizados com nomes inspirados em pessoas ou lugares: férmio (do físico italiano Enrico Fermi), mendelévio (do criador da tabela, Mendeleev), nobélio (do sueco Alfred Nobel, inventor da dinamite e idealizador do prêmio Nobel), rutherfórdio (do físico Ernest Rutherford), seabórgio (o primeiro a homenagear uma pessoa viva, o químico americano Glenn Seaborg), tennessínio (em homenagem ao estado do Tennessee) entre muitos outros.
Todos os elementos a partir do urânio são radioativos, e alguns, especialmente os mais pesados, são particularmente instáveis, decompondo-se em frações de segundo, o que torna muito difícil a identificação e a caracterização físico-química deles.
Mesmo assim, nas últimas décadas, houve grande empenho em completar a sétima linha da tabela, em especial de grupos alemães, russos, americanos e japoneses. O feito se deu com a descoberta do oganessônio (elemento 118), em 2002, e seu reconhecimento formal em 2016.
Agora os físicos nucleares miram nos elementos de número 119 em diante, mas obtê-los não será fácil. A meta é encontrar e caracterizar a chamada ilha de estabilidade desses elementos superpesados, ou seja, a combinação ideal de prótons e nêutrons em cada núcleo a fim de fazer elementos mais duráveis.
Com esse conhecimento, além de um aprendizado importante sobre física quântica, pode ser descoberto algum meio de se obter energia nuclear de forma mais eficiente.
A partir do conhecimento atual, contudo, é difícil até mesmo definir o que seria estabilidade nesses casos —se esses elementos durariam dias, horas ou meros segundos. De todo modo, cientistas já caminham para o número 119 e além.
Apesar de hoje já se saber quase tudo com relação aos elementos químicos, na área de nanomateriais (estruturas com dimensões da ordem de nanômetros, ou milionésimos de milímetro) ainda há muito a ser explorado, diz o químico da USP Henrique Toma.
Esses materiais apresentam propriedades eletrônicas, mecânicas e ópticas (forma como interagem com a luz) bem diferentes dos elementos em suas apresentações usuais. Toma aposta que essa é a próxima fronteira da pesquisa ligada aos elementos químicos.
Os grupos de cada cor
Hidrogênio
Diferentemente dos outros componentes da coluna, ele tem a forma de gás. Compõe a maior parte do Universo visível, e é a partir da energia que resta da transformação dele em hélio (He) no Sol que recebemos luz e calor na Terra
Metais alcalinos
Tirando o hidrogênio, os elementos da primeira coluna —lítio, sódio, potássio, rubídio, césio e frâncio— são os metais alcalinos que, em contato com a água, formam gás hidrogênio, altamente inflamável. São leves, brilhantes e moles
Metais alcalinos terrosos
Nesta família estão berílio, magnésio, cálcio, estrôncio, bário e rádio. Todos ocorrem na natureza. Esses metais tendem a ser prateados e também são relativamente moles e reagem com a água liberando hidrogênio (com exceção do berílio)
Elementos (ou metais) de transição
O bloco central da tabela tem os famosos ferro, ouro, cobre, platina e titânio. Eles tendem a ser duros e sólidos (a exceção é o mercúrio, líquido à temperatura ambiente); muitos deles fazem parte da indústria siderúrgica
Terras raras
As duas últimas linhas são dos elementos conhecidos como terras raras. Os actinídios, que abrangem urânio e plutônio, são radioativos. Entre os lantanídios está o neodímio, elemento a partir do qual são feitos poderosos imãs
Metais ordinários
Ocupando um “triângulo” na tabela periódica e com elementos como alumínio, estanho e chumbo, esses metais são moles ou quebradiços e são facilmente fundidos.
Metaloides
Elementos dessa “diagonal” estão numa área cinzenta entre os metais e os não metais. Têm aparência metálica, mas não conduzem bem a eletricidade. São quebradiços e hoje são usados em lentes e em semicondutores.
Não metais
Carbono, nitrogênio, oxigênio, fósforo, enxofre e selênio—, assim como os das duas colunas seguintes —funcionam como isolantes térmicos e elétricos. Tendem a ser reativos e, desses seis, apenas o oxigênio é gasoso à temperatura ambiente
Halogênios
Flúor, cloro, bromo, iodo e astato também são não metais, mas têm características especialmente reativas e formam sais com outros elementos (como o sódio, que forma o NaCl, o sal de cozinha).
Gases nobres
Hélio, neônio, argônio, criptônio, xenônio, radônio —são pouco reativos, o que permite que sejam usados para criar ambientes inertes, que protegem outras substâncias






Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.