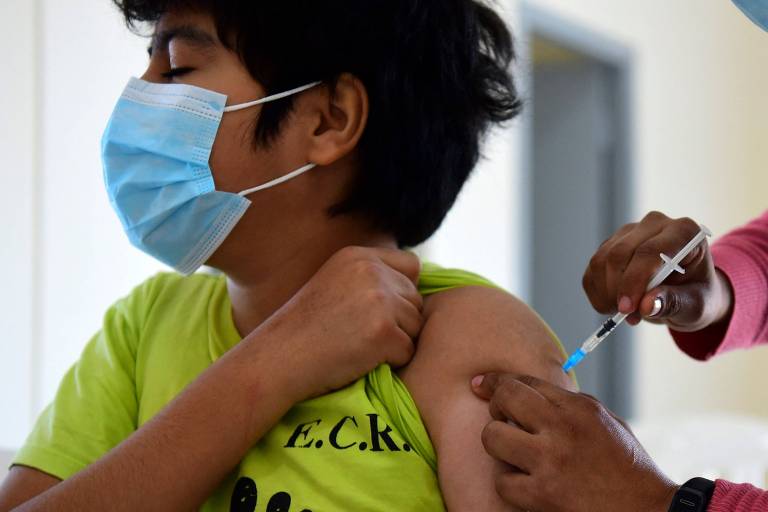
A Pfizer e a BioNTech disseram nesta segunda-feira (20) que sua vacina contra Covid-19 induziu uma forte resposta imunológica em crianças de 5 a 11 anos. As farmacêuticas pretendem pedir autorização para uso do imunizante em pessoas dessa faixa etária nos Estados Unidos, na Europa e em outros lugares assim que possível.
As farmacêuticas disseram que a vacina gerou uma reação imune nas crianças em seu teste clínico de fase 2/3 que se equipara ao que foi observado em jovens de 16 a 25 anos. O perfil de segurança também foi de modo geral comparável ao grupo de idade maior, afirmaram.
"Desde julho, os casos pediátricos de Covid-19 aumentaram cerca de 240% nos Estados Unidos, salientando a necessidade de vacinação para a saúde pública", disse o diretor-executivo da Pfizer, Albert Bourla, em um comunicado à imprensa.
"Esses resultados dos testes oferecem uma forte base para buscarmos a autorização de nossa vacina para crianças de 5 a 11 anos, e pretendemos apresentá-los à Agência de Alimentos e Drogas [FDA na sigla em inglês] e a outros órgãos reguladores com urgência."
Autoridades de saúde graduadas dos EUA acreditam que os reguladores poderão tomar uma decisão sobre a segurança e a eficácia da vacina em crianças três semanas depois de as empresas apresentarem o pedido de autorização, disseram à Reuters duas fontes no início deste mês.
No Brasil, a reportagem da Folha entrou em contato nesta segunda-feira com a assessoria de comunicação da Pfizer no país, para saber se os dados serão também apresentados em um pedido à Anvisa (Agência Nacional de Vigilância Sanitária). A empresa, até o momento, não se pronunciou sobre o assunto.
As internações e mortes por Covid-19 aumentaram nos EUA nos últimos meses devido à variante delta, altamente contagiosa. Os casos pediátricos também cresceram, particularmente porque nenhuma pessoa com menos de 12 anos foi vacinada, mas não há indícios de que, além de ser mais transmissível, a variante delta seja mais perigosa para crianças.
Uma autorização rápida poderá ajudar a atenuar um potencial aumento de casos no outono, especialmente com as escolas já abertas em todo o país.
A vacina das companhias, chamada Comirnaty, já é autorizada para uso em crianças a partir de 12 anos em muitos países, incluindo os EUA e o Brasil. Ela foi autorizada originalmente para uso emergencial em pessoas de 16 anos ou mais nos EUA em dezembro de 2020 e recebeu aprovação plena no país para essa faixa etária no mês passado.
Nos testes com crianças de 5 a 11 anos, elas receberam duas injeções de uma dose de 10 microgramas da vacina, um terço da dose aplicada nas pessoas de 12 anos ou mais. As empresas esperam dados sobre o funcionamento do imunizante em crianças de 2 a 5 anos e de 6 meses a 2 anos ainda no quarto trimestre deste ano.
Diferentemente do teste clínico maior que os laboratórios realizaram em adultos antes, o teste pediátrico com 2.268 participantes não foi desenhado a princípio para medir a eficácia da vacina comparando o número de casos de Covid-19 em pessoas imunizadas com o número dos que receberam um placebo.
Em vez disso, as companhias comparam a quantidade de anticorpos neutralizantes induzidos pela vacina nas crianças com a reação dos receptores no teste com adultos.
Um porta-voz da Pfizer disse que as empresas poderão mais tarde revelar a eficácia da vacina no teste, mas ainda não houve casos suficientes de Covid entre os participantes para chegar a esse valor.
A vacina foi aproximadamente 95% eficaz no teste clínico com adultos, mas a Pfizer disse que a imunidade diminui alguns meses após a segunda dose. Por esse motivo, os reguladores dos EUA deverão autorizar uma dose de reforço para americanos idosos e de alto risco nesta semana.
Segundo os laboratórios, a vacina foi bem tolerada, com efeitos colaterais geralmente comparáveis aos observados em participantes de 16 a 25 anos.
Tanto a vacina da Pfizer quanto a da Moderna foram associadas pelos reguladores a casos raros de inflamação cardíaca em adolescentes e jovens adultos, particularmente homens. A Pfizer disse que não houve qualquer caso de inflamação cardíaca nos participantes do teste.




Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.