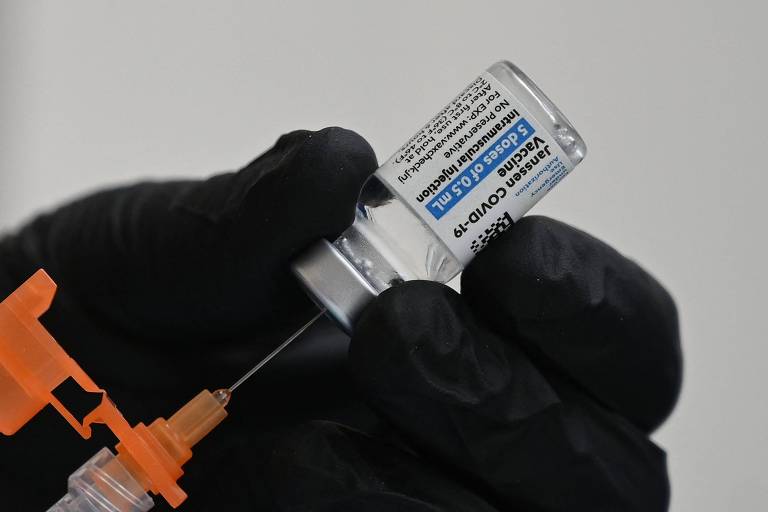
A Anvisa (Agência Nacional de Vigilância Sanitária) publicou nesta terça-feira (5) o registro definitivo da vacina da Janssen contra a Covid-19. A vacina já estava aprovada para uso emergencial desde 31 de março de 2021.
Diferentemente de outros imunizantes, ele necessita de apenas uma dose no ciclo primário. O Ministério da Saúde adotou a dose de reforço para quem tomou a vacina, que é indicada para pessoas com 18 anos ou mais.
Além de contemplar a imunização primária, o registro na agência reguladora inclui a aprovação da dose de reforço.
"A vacina também pode ser administrada como uma dose de reforço heteróloga (de vacina diferente), para pessoas que concluíram a vacinação primária com uma vacina de tecnologia mRNA. Atualmente, a única vacina de mRNA aprovada no Brasil é a vacina da Pfizer. Nesse caso, o intervalo para a dose de reforço é igual ao autorizado para a vacina utilizada na vacinação primária", disse a Anvisa, em nota.
A Anvisa disse que os requisitos para a concessão do registro são mais complexos que os exigidos na autorização para uso emergencial, já que esta modalidade foi criada excepcionalmente, para atender à urgência imposta pelo surto do novo coronavírus.
São necessários para o registro, por exemplo, dados de estudos de estabilidade completos, que permitem estabelecer o prazo de validade e modelos de bula e rotulagem capazes de favorecer o uso racional da vacina.
Também são exigidos dados complementares de qualidade, da cadeia de transporte e os resultados dos estudos clínicos da fase 3, ou seja, realizados com um maior número de voluntários para avaliar a segurança e a eficácia da vacina.
Outra diferença importante entre as modalidades de autorização é que a liberação para uso emergencial é restrita a um público-alvo e predefinido. Além disso, os imunizantes submetidos ao uso excepcional só podem ser aplicados no Sistema Único de Saúde. Já no caso do registro sanitário, o fabricante recebe autorização para que as vacinas sejam utilizadas amplamente no país, nos sistemas público e privado.
No Brasil, a única vacina contra a Covid que ainda conta somente com o registro de uso emergencial é a Coronavac.
A Anvisa recebeu do Instituto Butantan um pedido para a ampliação do uso da vacina Coronavac em crianças de 3 a 5 anos, mas a agência reguladora pediu mais dados.
A agência já aprovou o imunizante para crianças e adolescentes de 6 a 17 anos em janeiro deste ano.
Na ocasião, a Anvisa vetou a aplicação da vacina para o público de 3 a 5 anos ao entender que não existiam dados suficientes para autorizar o imunizante nessa faixa etária.



Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.