Dentro de cada tumor canceroso há moléculas que estimulam o crescimento mortal e incontrolável. E se os cientistas pudessem ligar essas moléculas a outras para fazer as células se destruírem? Poderiam os próprios motores da sobrevivência de um câncer ativar, em vez disso, o programa de sua destruição?
Essa ideia chegou como revelação ao biólogo do desenvolvimento Gerald Crabtree, da Universidade Stanford, alguns anos atrás, quando ele estava caminhando entre sequoias perto de sua casa nos montes Santa Cruz.
"Voltei para casa correndo", ele contou, empolgado com a ideia e pensando em maneiras de colocá-la em prática.
Agora, em artigo publicado em 26 de julho na revista Nature, Crabtree —fundador da Shenandoah Therapeutics, que está desenvolvendo medicamentos contra o câncer—, juntamente com Nathanael Gray, professor de bioquímica e biologia de sistemas em Stanford, e seus colegas, informam que realizaram o que Crabtree idealizou durante aquela caminhada. Embora o conceito ainda esteja longe de ser um medicamento que possa ser dado a pacientes com câncer, pode ser um objetivo para desenvolvedores de medicamentos no futuro.
"É muito bacana", comentou Jason Gestwicki, professor de química farmacêutica na Universidade da Califórnia em San Francisco. "A ideia é converter algo que a célula cancerosa necessita para continuar viva em algo que a mata. Seria como converter sua vitamina em um veneno."
Louis Staudt, diretor do Centro de Genômica Oncológica do Instituto Nacional do Câncer, disse: "Esta é uma maneira potencialmente nova de fazer o câncer se voltar contra ele mesmo". Staudt escreveu um editorial para acompanhar o artigo de Crabtree.
Ele disse que depois que o tratamento tiver sido desenvolvido, "vou gostar muito de poder experimentá-lo em um ensaio clínico com nossos pacientes que já esgotaram todas as outras opções".
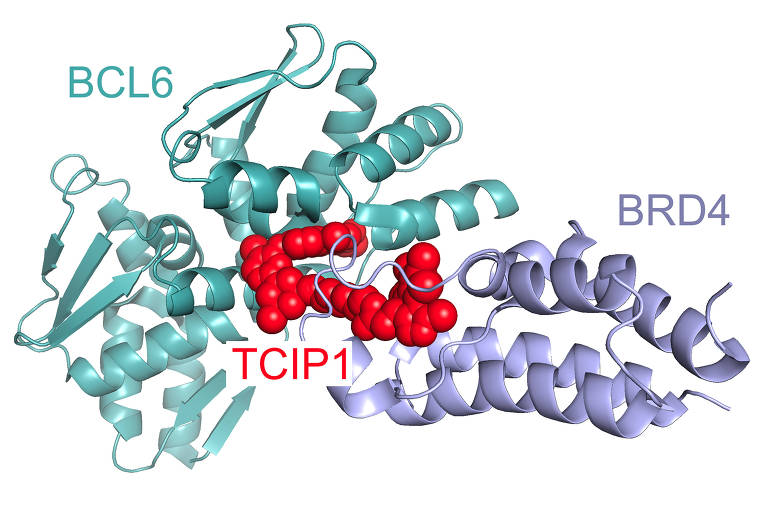
Em experimentos laboratoriais com células de um tipo de câncer do sangue, o linforma difuso de células B grandes, pesquisadores desenharam e construíram moléculas que ligaram duas proteínas: a BCL6, uma proteína que passou por mutação e da qual o câncer depende para crescer agressivamente e sobreviver, e uma proteína celular normal que ativa quaisquer genes dos quais se aproxima.
A nova construção, uma molécula em formato de haltere, difere de qualquer coisa vista na natureza. A NCL6, em uma extremidade do haltere, conduz a molécula na direção dos genes de morte celular que fazem parte do DNA de toda célula e são usados para eliminar células que não são mais necessárias. Mas quando uma pessoa tem linforma difuso de células B grandes, a BCL6 desativou esses genes de morte celular, essencialmente tornando as células imortais.
Quando o altere, guiado pelo BCL6, se aproxima dos genes de morte celular, a proteína normal presente na outra ponta do altere ativa esses genes de morte. Diferentemente de outros processos celulares que podem ser revertidos, a ativação dos genes de morte celular é irreversível.
A nova abordagem poderia representar uma melhora em relação à tarefa difícil de usar drogas para bloquear todas as moléculas de BCL6. Com as moléculas em formato de halter, basta religar apenas uma parcela das moléculas de BCL6 para matar células.
O conceito tem o potencial de funcionar em metade de todos os tipos de câncer, os que possuem mutações conhecidas que geram proteínas que promovem o crescimento, disse Crabtree. E, pelo fato de o tratamento depender das proteínas que passaram por mutação produzida pelas células cancerosas, ele pode ser extremamente específico, poupando as células sadias.
Crabtree explicou as duas áreas de descoberta que possibilitaram o trabalho. Uma delas é a descoberta dos chamados "genes condutores" —várias centenas de genes que, quando passam por mutação, impulsionam o alastramento do câncer.
A segunda área é a descoberta dos caminhos de morte nas células. Esses caminhos, disse Crabtree, "são usados para eliminar células que por um motivo ou outro começaram a agir descontroladamente" —caso de 60 bilhões de células por dia em cada indivíduo.
A questão foi fazer os caminhos que promovem o crescimento das células cancerosas comunicar-se com os caminhos silenciados que impulsionam a morte de células, algo que normalmente não ocorreria.
Quando a molécula híbrida chegou ao DNA das células, ela não apenas ativou os genes de morte celular como fez mais. A BCL6 conduziu a molécula híbrida a outros genes que o câncer havia silenciado. A molécula híbrida reativou esses genes, criando caos interno na célula.
"A célula nunca passou por isso", disse Staudt.
"A BCL6 é o princípio organizador dessas células cancerosas", ele explicou. Quando sua função é totalmente atrapalhada, "a célula perde sua identidade e diz ‘alguma coisa de muito errado está acontecendo aqui. O melhor que tenho a fazer é morrer.’"
Mas, disse Crabtree, o efeito principal do tratamento experimental foi ativar os genes de morte celular. "Esse é o efeito terapêutico", ele disse.
O grupo testou sua molécula híbrida em camundongos, com os quais ela pareceu segura. Mas Staudt destacou que "os humanos são muito diferentes dos camundongos".
Stuart Schreiber, professor de química e bioquímica na Universidade Harvard e colaborador de Crabtree em trabalhos anteriores, descreveu o trabalho como "empolgante", mas fez uma ressalva.
O que Crabtree criou, ele disse, "não é um medicamento. Ainda tem um longo caminho a percorrer para sê-lo."
Tradução de Clara Allain




Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.