A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou nesta sexta-feira (16) o uso da vacina da Pfizer contra Covid-19 em crianças de 6 meses a 4 anos.
Após análise técnica de dados e estudos clínicos conduzidos pelo seu laboratório, a agência divulgou que as informações avaliadas indicam que a vacina é segura e eficaz para as crianças dessa faixa etária.
Com a autorização, cabe ao Ministério da Saúde definir o calendário para iniciar a utilização das doses no país.
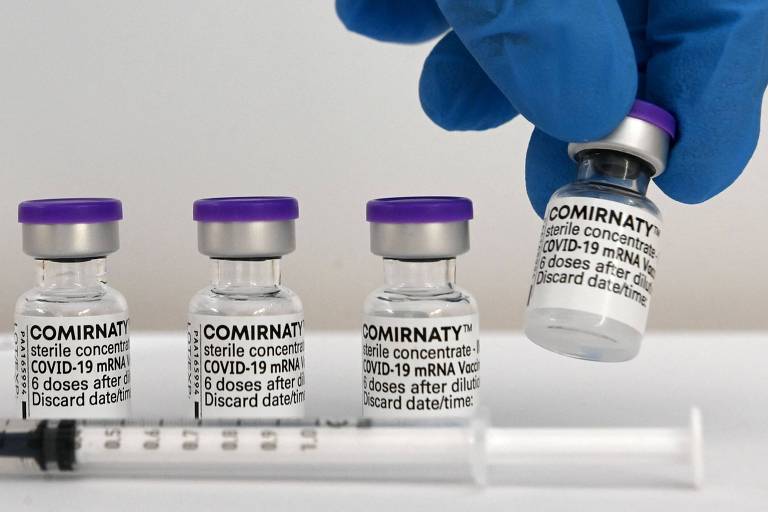
Para diferenciá-la das demais, a vacina voltada à nova faixa etária será identificada pelo frasco com tampa de cor vinho. Para crianças de 5 a 11 anos, a tampa é laranja e, para o público acima de 12 anos, roxa.
O uso de diferentes cores de tampa é uma estratégia para evitar erros de administração, pois o produto requer diferentes dosagens conforme a idade das crianças. Isso facilita a identificação pelas equipes de vacinação e, também, pelos responsáveis pelos pequenos.
"A formulação da vacina autorizada deverá ser aplicada em três doses de 0,2 mL (equivalente a 3 microgramas). As duas doses iniciais devem ser administradas com três semanas de intervalo, seguidas por uma terceira dose administrada pelo menos oito semanas após a segunda dose", declarou a Anvisa, em nota.
Segundo a agência, a vacina tem 12 meses de validade, quando armazenada a temperatura entre -90°C e -60°C. Depois de retirado do congelamento, o frasco fechado pode ser armazenado em geladeira entre 2°C e 8°C por até dez semanas, não excedendo a data de validade original.
A Anvisa diz que contou com a consulta e o acompanhamento de um grupo de especialistas de sociedades médicas para autorizar o uso da vacina. Participaram do processo de avaliação especialistas da Associação Brasileira de Saúde Coletiva (Abrasco), da Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), da Sociedade Brasileira de Infectologia (SBI), da Sociedade Brasileira de Imunologia (SBI) e da Sociedade Brasileira de Pediatria (SBP).
O uso da vacina da Pfizer em crianças no país foi aprovado inicialmente em dezembro do ano passado, quando a agência der sinal verde para aplicação em menores a partir de cinco anos.
A decisão suscitou queixas do presidente Jair Bolsonaro (PL). À época, ele anunciou ter solicitado extraoficialmente o nome dos técnicos da Anvisa envolvidos na aprovação, a fim de divulgá-los "para que todo mundo tome conhecimento quem são essas pessoas e obviamente forme seu juízo".
Depois, sugeriu ainda, sem apresentar qualquer evidência, haver "interesses" da agência na decisão.
No mês seguinte, em 20 de janeiro, foi autorizada a utilização da Coronavac em crianças com mais de seis anos.
A discussão da vacinação infantil desencadeou uma onda de ameaças a técnicos e diretores da Anvisa. No começo deste ano, somavam mais de 300.
Mais tarde, em julho, a agência deu aval ao uso emergencial de doses da Coronavac em criança de 3 a 5 anos.



Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.