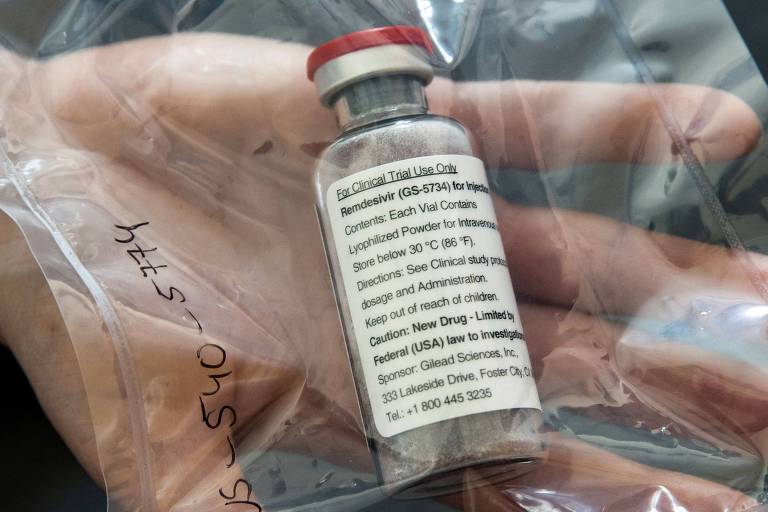
A FDA (agência que regula remédios e alimentos), dos EUA, concedeu uma autorização para uso do antiviral remdesivir em pacientes (tanto adultos quanto crianças) graves com suspeita ou confirmação da Covid-19.
Com o autorização de uso emergencial, o antiviral poderá ser dados por profissionais de saúde a pacientes com níveis baixos de oxigenação no sangue ou que precisem de ajudar de respiradores.
"Baseado na totalidade das evidências científicas disponíveis, é razoável crer que o remdesivir possa ser efetivo no tratamento da Covid-19 e que, quando usado sob as condições descritas nesta autorização, os conhecidos e potenciais benefícios superam os conhecidos e potenciais riscos da droga", afirma o documento da FDA.
A autorização já era esperada após a divulgação, na quarta (29), de resultados modestamente positivos da droga contra o novo coronavírus.
O estudo conduzido pelo NIH (National Institutes of Health), dos EUA, apontou que a droga pode diminuir o tempo de recuperação de pacientes graves. Na pesquisa, o grupo controle, que tomou placebo, levava em média 15 dias para se recuperar. Enquanto isso, o grupo de pacientes nos quais o remdesivir foi administrado precisou de 11 dias para receber alta hospitalar.
Ao anunciar alguns dos dados do estudo (que ainda não foi apresentado em sua íntegra), Anthony Fauci, diretor do Instituto Nacional de Alergia e Doenças Infecciosas (Niaid, na sigla em inglês), braço do NIH, comparou a divulgação aos primeiros resultados positivos da droga AZT contra o HIV, o que representou uma reviravolta no tratamento da doença.
Mesmo com a animação de Fauci, os dados parciais apresentados não representam a solução da guerra contra a Covid-19. Contudo, “provou-se um conceito”, disse o diretor do Niaid, “um remédio pode conter esse vírus”.
O estudo do Niaid tinha um desenho forte: era randomizado, duplo-cego (tanto médicos quanto pacientes não sabiam o que estavam medicando ou recebendo) e com grupo controle. Isso faz com que o nível de evidência obtido sobre a droga seja mais forte e permita conclusões mais seguras.
O registro de ensaios clínicos do estudo do NIH chamou a atenção após o anúncio de Fauci. O desfecho a ser analisado foi alterado pelos pesquisadores em 20 de março, quando o estudo já estava em andamento.
O resultado final em análise pelo estudo, como foi apresentado na quarta, foi o tempo que o paciente levou para recuperação. Já o resultado que inicialmente seria analisado era mais complexo e levava em conta uma escala baseada em uma série de parâmetros clínicos.
A mudança do resultado principal em estudo pode levar a distorções nos resultados encontrados quanto ao tratamento foco da pesquisa.
Segundo pesquisadores, o resultado é interessante, mas ainda é necessária cautela considerando as evidências disponíveis sobre o uso da droga contra a Covid-19, principalmente considerando os dados aparentemente conflitantes com o estudo publicado, nesta quarta (29), na revista The Lancet, que não aponta efeito estatisticamente relevante da droga (o estudo teve que ser interrompido e os dados obtidos são frágeis).
Além da mudança no desfecho analisado, o estudo em si ainda não foi apresentado, o que torna impossível uma análise mais detalhada dos dados, diz Natália Pasternak, pesquisadora do Instituto de Ciências Biomédicas da USP e presidente do Instituto Questão de Ciência. Mas, "no meio de uma pandemia, qualquer remédio que ajuda é bem-vindo", diz a pesquisadora.
Ela afirma, contudo, que a mudança do resultado principal em análise na pesquisa precisa ser explicado.
Ao mesmos tempo, também na quarta, um estudo publicado na revista médica inglesa The Lancet estatisticamente não mostrou benefício do uso da droga em pacientes com Covid-19. A pesquisa, feita na China, teve que ser interrompida, por falta de pacientes, o que enfraquece os dados e dificulta as análises.
O remdesivir é produzido pela farmacêutica Gilead Sciences e foi desenvolvido para tratar outras doenças. Foi testado, com pouco sucesso contra o Ebola e teve resultados promissores contra outros coronavírus em testes em animais. Não fora até agora aprovado para tratamento de nenhuma doença.
A Anvisa (Agência Nacional de Vigilância Sanitária), em nota, afirma que fará uma reunião com a farmacêutica para verificar a viabilidade do fornecimento do medicamento no Brasil e que acompanha a evolução dos estudos sobre a droga.
"Caso o benefício do medicamento se comprove, a Anvisa possui mecanismos, como anuência de uso em programa assistencial e priorização de registro, para garantir o acesso célere do medicamento à população", diz a agência brasileira, que também afirma que o remdesivir não tem pedido de registro no Brasil.



Comentários
Os comentários não representam a opinião do jornal; a responsabilidade é do autor da mensagem.